Termoquímica: Conceitos Fundamentais para o ENEM
Termoquímica: Conceitos Fundamentais para o ENEM
A termoquímica é uma área da química que estuda as transformações de energia associadas às reações químicas.
Compreender os conceitos básicos de termoquímica é essencial para quem está se preparando para o Exame Nacional do Ensino Médio (ENEM), pois esta disciplina é frequentemente abordada nas questões de química.
Vamos explorar os principais pontos que você precisa dominar:
Índice:
Dicas extras para o ENEM |
1. Energia e Transformações Químicas
A energia é a capacidade de realizar trabalho ou transferir calor. Nas reações químicas, ocorrem mudanças energéticas que podem ser classificadas em dois tipos principais:
Reações exotérmicas:** liberam energia para o ambiente, geralmente na forma de calor. Exemplos comuns incluem a combustão de combustíveis e a formação de água a partir de hidrogênio e oxigênio.
Reações endotérmicas:** absorvem energia do ambiente. A fotossíntese e a decomposição térmica de carbonatos são exemplos de reações endotérmicas.
2. Entalpia (H)
A entalpia é uma grandeza termodinâmica que representa o conteúdo de calor de um sistema em pressão constante. As variações de entalpia (\(\Delta H\)) são fundamentais para entender as reações químicas:

3. Calor de Reação
O calor de reação é a quantidade de calor envolvida em uma reação química. Pode ser medido em condições padrão (25°C e 1 atm), e é comumente expresso em quilojoules por mol (kJ/mol). As equações termoquímicas representam as reações químicas acompanhadas pelas suas respectivas variações de entalpia.
4. Lei de Hess
A Lei de Hess afirma que a variação de entalpia total de uma reação química é a mesma, independentemente do caminho que a reação segue. Isso significa que podemos somar as variações de entalpia de etapas intermediárias para encontrar a variação de entalpia total de uma reação complexa.
5. Energia de Ligação
A energia de ligação é a quantidade de energia necessária para quebrar uma ligação química em uma molécula. As variações de entalpia de uma reação podem ser estimadas usando as energias de ligação das moléculas reagentes e produtos.
6. Entropia (S) e Energia Livre de Gibbs (G)
A entropia é uma medida da desordem de um sistema. A segunda lei da termodinâmica afirma que a entropia do universo sempre aumenta em processos espontâneos. A Energia Livre de Gibbs (\(G\)) é uma função que combina entalpia e entropia para prever a espontaneidade das reações:

A fórmula da Energia Livre de Gibbs é:
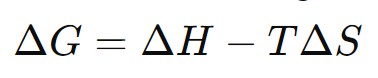
Dicas extras para o ENEM
1. Foque nos conceitos:
Entenda bem os conceitos de entalpia, energia livre e entropia.
2. Equações termoquímicas:
Pratique a leitura e interpretação de equações que mostram variações de entalpia.
3. Exercícios:
Resolva muitos exercícios para familiarizar-se com cálculos de 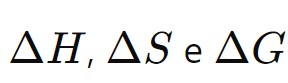 4. Lei de Hess:
4. Lei de Hess:
Tenha certeza de entender como aplicar a Lei de Hess para calcular variações de entalpia em reações complexas.
A termoquímica pode parecer desafiadora, mas com prática e entendimento dos conceitos básicos, você estará preparado para enfrentar as questões do ENEM. Boa sorte nos seus estudos!
Veja aqui toda a Matéria do ENEM